Le syndrome d’apnées obstructives du sommeil (SAOS) correspond à des
collapsus du pharynx, complets ou partiels, survenant de manière répétée au
cours du sommeil. Ces collapsus répétés du pharynx ont quatre conséquences
principales : survenue de séquences désaturation-réoxygénation, épisodes
transitoires d’hyper capnie, efforts respiratoires augmentés et survenue de
micro-éveils terminant les événements respiratoires. Le SAOS est favorisé, en
dehors d’anomalies constituées réduisant le diamètre des voies aériennes
supérieures (rétrognathisme, micrognathisme, etc.), par l’excès de poids
(surpoids/obésité) qui réduit les volumes thoraciques et le calibre des voies
aériennes supérieures(1).
En raison du facteur de risque commun que représente l’obésité, notamment
l’obésité abdominale, SAOS et diabète de type 2 sont fréquemment associés. Il
apparaît toutefois que l’association entre SAOS et diabète n’est pas simplement
liée à ce facteur étiologique commun et dépasse le seul cadre du diabète de
type 2 (DT2). Le SAOS est ainsi fréquent chez les personnes avec un diabète de
type 1 (DT1) et pourrait également favoriser le diabète gestationnel.

Épidémiologie du SAOS
En population générale
En Europe, une étude suisse récente a évalué la prévalence du SAOS à partir d’une cohorte en population générale. Dans cette cohorte appelée « Hypno-LAus », 48 % des participants étaient des hommes, d’âge médian 57 ans et d’indice de masse corporelle (IMC) moyen 25,6 kg/m². La prévalence de TRS modérés à sévères, dépistés par polysomnographie, était de 49,7 % chez les hommes et 23,4 % chez les femmes. La prévalence du SAOS modéré à sévère était environ de 7 % pour les hommes et 2 % pour les femmes de moins de 60 ans. Les facteurs associés aux TRS étaient l’âge, le sexe masculin, l’IMC, le tour de cou, le rapport taille sur hanches, le ronflement, mais pas la somnolence diurne (score d’Epworth). Les comorbidités associées, dans des modèles ajustés, étaient l’hypertension artérielle, le diabète, le syndrome métabolique et la dépression(2).
Chez les sujets qui ont un diabète
Plusieurs études ont permis d’évaluer la prévalence des TRS chez les patients ayant un diabète (tableau 1). Celle-ci est élevée chez les patients qui présentent un diabète de type 2, elle varie selon les populations étudiées, de 58 à 86 % pour un IAH > 5 et de 18 à 53,1 % pour les formes modérées et sévères. Dans la cohorte française ENTRED, la présence d’un SAOS a été évaluée à l’aide d’autoquestionnaires chez 3 894 personnes porteuses d’un DT2 sélectionnées au hasard à partir des bases de données de l’assurance maladie. Le SAOS était déjà connu chez 8,5 % de ces patients, mais 16 % supplémentaires des sujets de la cohorte présentaient des signes cliniques évocateurs de SAOS : ronflements fréquents associés à une somnolence excessive et/ou des apnées constatées par l’entourage(3).
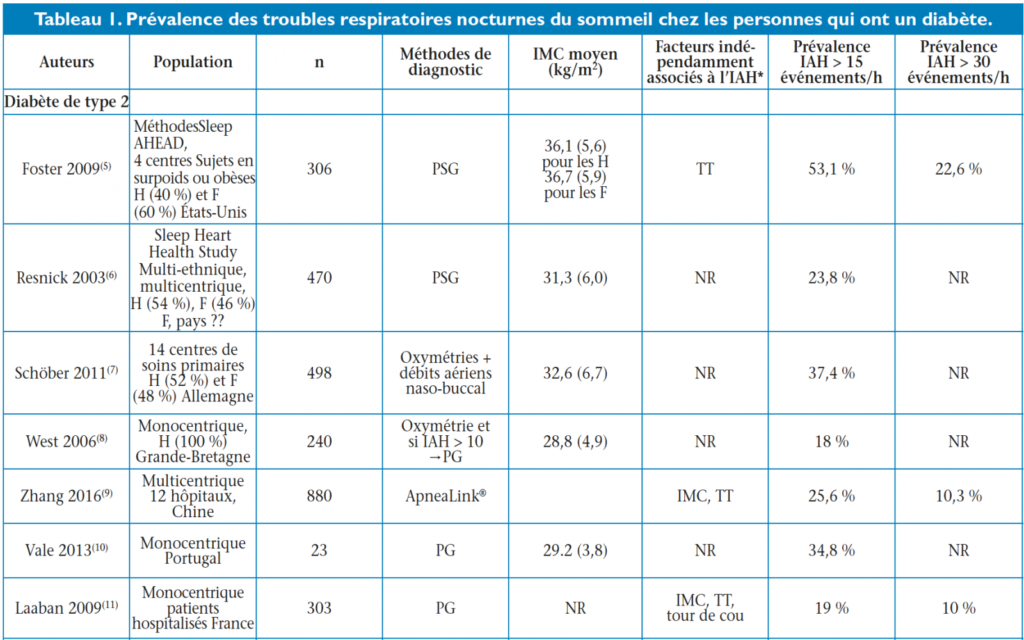
La prévalence des TRS modérés à sévères est également élevée chez les personnes avec un DT1, variant de 10,3 à 40 % selon les études (tableau 2) ; elle est évaluée en moyenne à 16,7 % par une métaanalyse récente(4).

Incidence du diabète chez les sujets qui ont un SAOS Une métaanalyse publiée en 2016 a rassemblé les résultats de 8 études qui ont analysé le risque de diabète incident chez des patients apnéiques comparés à des sujets non apnéiques. Elle retrouvait un risque significatif de diabète incident avec une hétérogénéité modérée entre les études (I2 : 47,9 %). Le risque relatif (RR) était de 2,02 (IC95% : 1,57-2,61) avec un risque similaire sur les deux études qui ont utilisé le seuil d’IAH > 5 actuellement utilisé pour définir un SAOS léger. Après ajustement pour l’âge, le sexe et l’IMC, le RR était atténué à 1,49 (IC95% : 1,27-1,75) pour les 8 études et 1,42 (IC95% : 1,02-1,99) pour les 2 études utilisant le critère d’IAH à 5(14).
Mécanismes physiopathologiques associés au SAOS
Conséquences immédiates
Les conséquences immédiates des événements respiratoires survenant au cours du sommeil sont représentées par une hypoxie intermittente (survenue séquentielle de phénomènes cycliques de désaturation-réoxygénation), une augmentation transitoire de la capnie durant le collapsus pharyngé, des variations considérables des pressions intrathoraciques du fait des efforts respiratoires du patient pour lutter contre le collapsus, la survenue de microéveils terminant les événements respiratoires et entraînant une fragmentation du sommeil. Parmi ces stimuli, la sévérité de l’hypoxémie intermittente nocturne est le principal déterminant et prédicteur des complications cardiovasculaires et métaboliques.
Mécanismes intermédiaires
Les stimuli contemporains de chaque événement respiratoire vont engendrer des mécanismes chroniques d’adaptation à l’hypoxie intermittente. Des études sur cultures cellulaires, sur modèles animaux et chez l’homme ont permis de montrer que l’hypoxie intermittente entraîne une hyperactivité sympathique(15,16), une inflammation systémique et vasculaire via NFkB(17-20), un stress oxydant(21) et une stimulation pro-inflammatoire du tissu adipeux via l’hypoxie et HIF-1 (diminution des adiponectines, infiltration macrophagique via une augmentation de MCP1)(22,23). La fragmentation du sommeil entraîne également des perturbations du cycle nycthéméral de la sécrétion de cortisol et de l’axe somatotrope entraînant une baisse de l’IGF-1(24-27).
Conséquences de ces mécanismes intermédiaires
• Dysfonction endothéliale,
modification tensionnelle, rigidité artérielle
L’hyperactivité sympathique, l’inflammation et le stress oxydant conduisent à
une dysfonction endothéliale, un remodelage vasculaire caractérisé par une
augmentation de la rigidité artérielle et de l’athérosclérose(28,29). Ces mécanismes sont
à l’origine de l’association dose-réponse très forte entre SAOS et hypertension
artérielle. La dysfonction endothéliale et par conséquent l’altération
microcirculatoire pourraient contribuer aux complications microvasculaires du
diabète en favorisant également l’augmentation des produits avancés de la
glycation et des altérations de la signalisation de la protéine kinase C(30-32).
• Insulinorésistance,
insulinosécrétion, dyslipidémie
L’hyperactivité sympathique augmente la glycogénolyse et la néoglucogenèse
hépatique. Les flux d’acides gras libres vers le foie et le muscle sont
également augmentés par activation de la lipolyse, ce qui favorise
l’insulinorésistance, mais aussi l’aggravation des hépatopathies non alcooliques
dysmétaboliques(33). Des études fondamentales ont montré un effet apoptotique de l’hypoxie
inter mittente sur des cellules bêta-pancréatiques(34,35) lié au stress
oxydant. L’hypoxie intermittente induit une inflammation du tissu adipeux et
favorise la lipolyse(36). La sévérité du SAOS est liée de manière dose-dépendante à la dyslipidémie
combinée ou dyslipidémie d’insulinorésistance (élévation des triglycérides et
baisse du HDL-C) après ajustement pour les facteurs confondants (figure)(37).
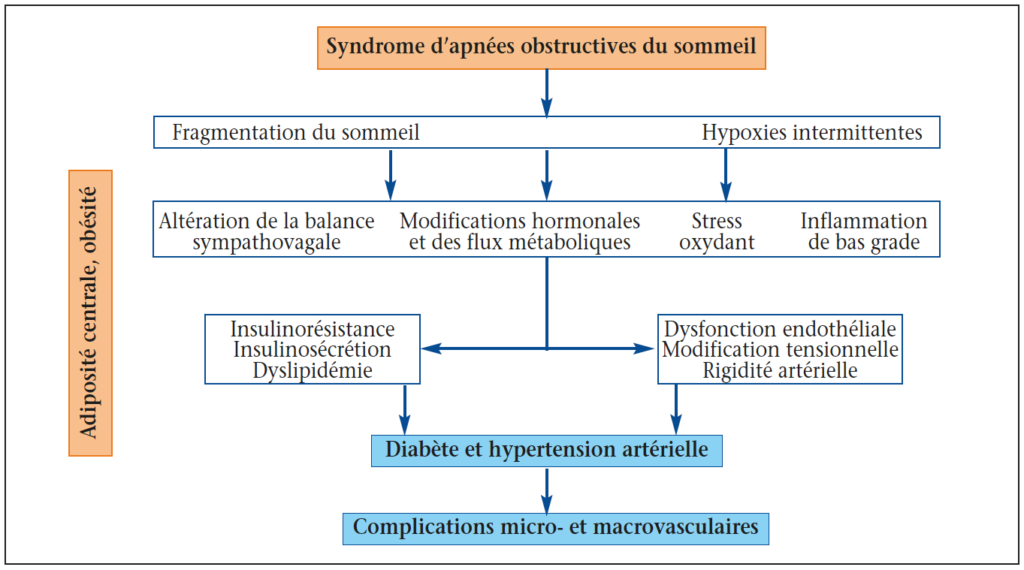
Figure. Synthèse des conséquences cardio-métaboliques du SAOS.
Les enjeux
Risque d’accidents et qualité de vie
La somnolence diurne doit être prise en compte dans l’évaluation de la sévérité du SAOS comme principal symptôme en lien avec la détérioration de la qualité de vie. L’hypovigilance diurne induite par la répétition des micro-éveils nocturnes qui fragmentent le sommeil peut être à l’origine de situations dangereuses liées au risque d’endormissement dans des circonstances telles que la conduite de véhicules ou le travail(38,39). Des troubles cognitifs (troubles de l’attention, de la mémoire et de la concentration) sont également au premier plan de l’altération de la qualité de vie des patients qui présentent un SAOS(40). De plus, elle est associée à une augmentation du risque d’accidents routiers évités et réels(38). Dans la problématique spécifique de la personne vivant avec un diabète, ce risque d’accident routier lié au SAOS s’ajoute au risque lié à celui de possibles hypoglycémies iatrogènes. Face à un événement aigu, les deux hypothèses doivent être évoquées.
Risque d’hypertension artérielle
Il existe une forte relation entre hypertension artérielle et SAOS. La prévalence de l’hypertension augmente de manière dosedépendante avec la sévérité du TRS(41-43). La prévalence du SAOS est de 83 % chez des patients ayant une hypertension artérielle résistante. Plusieurs cohortes ont montré que les TRS modérés à sévères (IAH > 15) sont associés à un risque de développer une hypertension.
Risque cardiovasculaire
Le pronostic cardiovasculaire du SAOS est dépendant des symptômes, de la quantité de désaturations nocturnes et surtout des comorbidités cardiométaboliques qui constituent le principal facteur pronostique de la maladie(44-46). Plusieurs études de cohortes ont montré que le SAOS est lui-même associé à une augmentation de la mortalité et de l’incidence des événements cardiovasculaires.
Qualité du contrôle glycémique
Plusieurs études ont mis en évidence une corrélation positive entre la sévérité du SAOS et l’augmentation de l’HbA1c chez des sujets présentant un diabète (essentiellement un DT2), y compris après ajustement sur les principaux facteurs de confusion et en utilisant plusieurs critères d’évaluation(47-51). La cohorte européenne ESADA(49) (6 616 sujets éligibles, suspects de TRS) a permis d’estimer la prévalence du DT2 chez les sujets apnéiques (17,2 %) et a retrouvé un effet-dose entre sévérité du SAOS et mauvais contrôle glycémique puisque les taux moyens ajustés d’HbA1c chez les patients porteurs d’un diabète étaient de 6,76 %, 6,70 %, 6,88 % et 7,48 % respectivement chez les sujets dont le SAOS était absent, léger, moyen ou sévère, avec un écart absolu de 0,72 % entre le groupe SAOS sévère et le groupe sans SAOS (p < 0,001).
Complications microvasculaires du diabète
Dans une métaanalyse
de 7 études chez des personnes avec un DT2, le SAOS est associé à une
augmentation du risque de diminution de la filtration glomérulaire au-dessous
de 60 ml/min (OR 1,59, IC95% : 1,16-2,18)(52). Une étude de cohorte portant sur 196
patients ayant un diabète de type 2 avec un suivi sur 2,5 ans révèle que les
patients avec un SAOS ont un déclin plus rapide de leur débit de filtration
glomérulaire, comparés à ceux qui ne présentent pas de SAOS. Cette même cohorte
a montré, chez 168 sujets, que le SAOS est un facteur prédictif d’évolution
vers une rétinopathie préproliférative. Le SAOS ne semble pas influencer dans
cette cohorte la progression de la maculopathie (199 patients analysés)(53).
Une métaanalyse regroupant 868 patients avec un diabète de type 2 (5 études
transversales) a comparé la présence d’un SAOS chez des sujets avec neuropathie
diabétique (autonome et/ou sensitive) vs sans neuropathie diabétique : l’odds
ratio pour la présence d’un SAOS n’était pas significatif (OR 1,90 ;
IC95% : 0,97-3,71, p = 0,06)(54). Chez les patients ayant un DT1, les
données sont plus rares. Selon une étude transversale portant sur 67 patients,
la neuropathie autonome (diagnostiquée cliniquement) était significativement
plus fréquente comparée aux patients sans SAOS (37 vs 21 %)(12).
Traitement et surveillance
Quels sont les critères de mise en place d’un traitement ?
Chez toutes les
personnes ayant un SAOS, quelle qu’en soit la sévérité, les modifications
thérapeutiques du mode de vie visant la perte de poids, la réduction de la
consommation d’alcool, de tabac, de l’utilisation des hypnotiques et
l’augmentation de l’activité physique sont au coeur de la prise en charge.
L’amélioration de ces facteurs favorise en effet le contrôle des voies
aériennes supérieures et une diminution des apnées.
En France, la Haute Autorité de santé (HAS) (recommandations 2014, https://www.hassante.
fr/portail/jcms/c_1761160/
fr/apnees-du-sommeil-de-nouvelles-recommandations-de-prise-en-charge-des-patients)
recommande d’initier un traitement chez les patients ayant au moins 3 symptômes
parmi lesquels la somnolence diurne (ne pas uniquement prendre en compte
l’échelle d’Epworth). Les critères d’initiation d’un traitement sont résumés
dans l’encadré 1. Ces recommandations générales s’appliquent aux personnes avec un diabète.

Quelles sont les différentes modalités de traitement ?
• Pression positive
continue (PPC)
Grâce à un effet d’attelle pneumatique, l’application d’une PPC dans les voies
aériennes supérieures au cours du sommeil via un masque nasal ou nasobuccal
prévient le collapsus du pharynx(55). L’effet de la PPC sur les événements
respiratoires obstructifs au cours du sommeil et leurs conséquences directes
est constant et immédiat. Une observance minimale d’au moins 4 h/nuit est
souhaitable pour atteindre les objectifs thérapeutiques.
• Orthèses d’avancée
mandibulaire (OAM)
Le traitement par OAM constitue la principale alternative à la PPC. Deux
gouttières moulées sur les arcades dentaires et reliées l’une à l’autre
permettent de générer une avancée mandibulaire d’amplitude variable pour
augmenter le calibre du pharynx et en limiter la collapsibilité. La faisabilité
et l’efficacité thérapeutique des orthèses n’ont pas été évaluées
spécifiquement chez les personnes ayant un diabète. Les parodontopathies
sévères contre-indiquent notamment ce traitement, alors qu’elles sont plus
fréquentes chez les personnes avec un diabète.
Le traitement par OAM est indiqué en première intention dans le SAOS modéré (15
≤ IAH < 30) symptomatique en l’absence de risque cardiovasculaire élevé et
en deuxième intention dans les indications de la PPC, en cas de refus ou
d’intolérance de celleci (recommandations HAS 2014).
Impact attendu du traitement
Impact sur la symptomatologie clinique
Les effets bénéfiques
de la PPC sur la somnolence diurne et la qualité de vie ont été formellement
démontrés chez les patients porteurs de formes modérées à sévères de la maladie(56). Le traitement
régulier du SAOS modéré à sévère par PPC est associé à une réduction du risque
d’accident de la voie publique(40,57). Le bénéfice de la
PPC sur la somnolence et la qualité de vie a également été démontré dans des
populations diabétiques(58-60). Malik et coll.(61), dans une étude sur
182 patients tempèrent cette efficacité clinique en montrant une diminution
moindre (mais qui reste significative) des symptômes (ronflements, nycturie,
somnolence, qualité du sommeil) chez les patients ayant un diabète en
comparaison avec des patients sans diabète.
Le bénéfice de la PPC est généralement obtenu après quelques semaines avec un
retour à la normale de la qualité de vie. Après exclusion des diagnostics
différentiels, seuls 6 % des patients correctement traités par PPC présentent
une somnolence persistante(62).
Sur l’hypertension artérielle
Les études randomisées ayant testé les effets de la PPC sur la pression artérielle montrent dans la moitié de ces études une baisse tensionnelle modeste(63). Dans l’HTA résistante, une métaanalyse récente qui a regroupé les résultats de 5 études randomisées a trouvé, sur les enregistrements des 24 heures, une baisse de la pression artérielle systolique et diastolique de 4,78 mmHg (IC95% : -7,95 à -1,61) et de 2,95 mmHg (IC95% : -5,37 à -0,53), respectivement, dans le groupe traité par PPC(64). Ces résultats suggèrent que parmi les patients avec SAOS, ceux ayant une HTA résistante sont les meilleurs répondeurs à la PPC en termes de baisse tensionnelle. Une baisse de pression artérielle a également été observée sous PPC dans des études randomisées en population diabétique(59).
Sur le risque cardiovasculaire
Une étude
observationnelle a mis en évidence, au terme d’un suivi moyen de 10,1 ans, une
plus forte incidence d’événements cardiovasculaires chez les patients avec SAOS
sévère non traités que chez les patients traités par PPC et les participants
sains(65). Ces données suggéraient un effet préventif de la PPC.
Quatre études randomisées ont testé l’effet de la PPC sur les événements
cardiovasculaires chez des patients avec SAOS(66-69). La métaanalyse de
ces études a inclus 7 266 patients avec SAOS et n’a pas mis en évidence de
diminution du risque d’événements cardiovasculaires ni de réduction de la
mortalité cardiovasculaire ou totale. L’analyse en sous-groupes selon
l’adhérence au traitement (< ou > 4 h/nuit) ne met pas en évidence
d’interaction significative (p = 0,09).
Cependant, il faut souligner les limites de ces essais randomisés qui incluent
principalement des patients avec SAOS modéré et peu symptomatique avec une
adhésion faible au traitement (environ 3 h/nuit). Les patients plus sévères
sont exclus pour des raisons éthiques, ne pouvant être privés de traitement
efficace sur plusieurs années. Il est donc difficile de tirer une conclusion de
ces résultats pour l’ensemble de la population avec SAOS.
Sur l’équilibre glycémique et la prévention des complications microangiopathiques du diabète
Les effets du traitement par PPC sur la sensibilité à l’insuline et l’équilibre glycémique restent controversés. Les données de la littérature sont discordantes et issues d’études de qualité souvent discutable, de courte durée, et portant sur de faibles effectifs.
• Sensibilité à
l’insuline
Chez les sujets sans diabète, en dépit de nombreuses études observationnelles
négatives, une métaanalyse incluant 12 de ces études « avant-après » retrouve
un effet significatif de la PPC sur la sensibilité à l’insuline évaluée par
l’index HOMA-IR(70) ; un bénéfice modeste, mais significatif est également retrouvé dans une
métaanalyse portant sur 244 patients sans diabète inclus dans 5 essais
randomisés comparant PPC et placebo pendant 6 semaines à 6 mois(71-74).
Chez les patients avec un DT2 et un SAOS, un traitement de 12 à 16 semaines par
PPC a montré une amélioration de l’insulinosensibilité mesurée par clamp
euglycémique hyperinsulinémique(75,76).
Au regard de ces données, la PPC améliore de manière modeste, mais
significative le degré de sensibilité à l’insuline.
• Équilibre glycémique
Chez les personnes porteuses d’un DT2, les études d’observation ne retrouvent
pas de réduction significative de l’HbA1c sous PPC, sauf à
considérer les sous-groupes de sujets présentant un HbA1c initiale élevée(77,78).
À ce jour, seulement 4 essais randomisés contrôlés ont été publiés avec pour
objectif de mesurer l’effet de la PPC sur le contrôle glycémique de personnes
ayant un DT2. Dans l’étude de West et coll.(58), 42 hommes avec un DT2 présentant un
SAOS modéré à sévère ont été traités par PPC active ou inactive pendant 3 mois,
aucune différence n’a pu être mise en évidence sur l’HbA1c ou la
sensibilité à l’insuline mesurée par clamp. Shaw et coll.(59) ont inclus 298
sujets porteurs d’un DT2 (HbA1c moyenne initiale 7,3 %) dans un
essai randomisé de 6 mois comparant PPC vs « soins courants »
: aucune amélioration de l’HbA1c n’a été mise en évidence sous PPC
active, y compris quand l’analyse a été restreinte soit aux patients les plus
déséquilibrés pour leur diabète, soit aux patients présentant un SAOS sévère,
soit aux patients les plus observants. En revanche, dans l’étude de
Martinez-Ceron et coll.(79), 50 patients avec un DT2 (HbA1c moyenne 7,6 %) ont été
randomisés entre PPC et « soins courants », et une évolution significativement
favorable de l’HbA1c est retrouvée dans le groupe PPC vs groupe contrôle
(HbA1c -0,4 %, p < 0,03). Mokhlesi et coll.(78) ont réalisé une étude
« preuve de concept » en incluant 22 sujets avec un DT2 récemment diagnostiqués
ou sous traitement oral seulement ; les sujets ont dormi 7 jours dans le
laboratoire du sommeil, sous PPC active ou inactive, avec un temps
d’utilisation de la PPC contrôlé à 8 h/nuit. Après 1 semaine, la glycémie
moyenne des 24 heures s’est améliorée sous PPC active vs PPC
inactive ; le bénéfice était particulièrement net sur le profil glycémique
nocturne et d’autant plus marqué chez les patients ayant les glycémies les plus
élevées à l’inclusion. Par ailleurs, deux études ont mesuré les glycémies
interstitielles en continu la nuit grâce à des holters glycémiques, et
retrouvent, après plus d’un mois de PPC, une baisse significative de la moyenne
glycémique nocturne et une amélioration de la variabilité glycémique(80,81).
Il existe donc peu d’arguments pour penser que la PPC permette d’améliorer
l’HbA1c des personnes porteuses d’un DT2 (sauf peut-être lorsque celle-ci est
particulièrement élevée ?). Un traitement par PPC pourrait améliorer la
variabilité nocturne des glycémies, mais le niveau de preuves est faible.
Aucune étude interventionnelle n’a été conduite à ce jour chez des personnes
ayant un DT1.
• Complications
microvasculaires du diabète
Les études sont de trop faible effectif pour pouvoir évaluer l’effet du
traitement du SAOS.
Quel patient diabétique doit bénéficier d’un enregistrement du sommeil ?
Modalités du dépistage clinique
L’interrogatoire est
la première étape du dépistage d’un trouble respiratoire du sommeil. Compte
tenu de la prévalence élevée du SAOS, il doit s’adresser à l’ensemble des
patients avec un DT2, sans se limiter aux patients qui présentent les autres
facteurs de risque du SAOS (excès de poids de répartition centrale, sexe
masculin, âge > 50 ans).
Le clinicien peut poser quelques questions simples pour rechercher les
symptômes du SAOS (encadré 2). La présence de 3 symptômes parmi
ceux-ci justifie la réalisation d’un enregistrement diagnostique du sommeil. La
présence confirmée d’un trouble respiratoire nocturne associé à 3 symptômes
justifie la prescription d’un traitement chez les sujets avec un diabète comme
en population générale, dans le but premier d’améliorer ces symptômes.

Indépendamment des symptômes, nous suggérons dans le tableau 2 plusieurs situations cliniques dans lesquelles le patient avec un diabète peut espérer un bénéfice d’un traitement du SAOS, même en l’absence de symptômes fonctionnels de la maladie.
Dans le cas
particulier du DT1, le SAOS doit être évoqué, car sa prévalence, indépendante
de l’IMC, semble élevée. Il faut notamment porter attention aux patients ayant
un diabète ancien (> 20 ans) et en présence d’une neuropathie autonome(82). Il n’y a toutefois
pas d’étude sur les bénéfices du traitement spécifiquement dans cette
population. Dans cette situation, un test thérapeutique avec réévaluation du
bénéfice clinique peut être justifié.
Enfin, le risque d’accident de la route est augmenté chez les patients qui
présentent un SAOS. Il a été démontré que le traitement par PPC réduit ce
risque. Compte tenu de la prévalence élevée du SAOS dans la population des
patients porteurs d’un DT2, les conducteurs professionnels devraient être
systématiquement dépistés pour la présence d’un syndrome d’apnées du sommeil,
même en l’absence de symptômes évocateurs.
Pertinence des questionnaires de dépistage
Les questionnaires de
dépistage clinique du sommeil, tels que le questionnaire de Berlin, le
questionnaire STOP ou STOP-BANG ont été validés en population générale. Ces
questionnaires étudiés dans la population de patients ayant un DT2 ont montré
de faibles sensibilités et spécificités, avec dans le meilleur des cas (avec le
questionnaire de Berlin), seulement 69 % de sensibilité(83). La faible
spécificité de ces questionnaires dans la population DT2 peut s’expliquer par
la présence de plusieurs items correspondant à des facteurs associés communs
entre SAOS et DT2 : IMC élevé, tour de cou augmenté dénotant une obésité de
répartition centrale ou l’hypertension artérielle.
Le questionnaire d’Epworth est un questionnaire évaluant la somnolence diurne
subjective. La somnolence diurne excessive est l’un des symptômes principaux du
SAOS, mais ne concerne que 57 % des patients(84) alors qu’elle est présente dans
plus de 10 % de la population générale(85). Chez les patients présentant une
morbidité cardio-métabolique (hypertension artérielle réfractaire, insuffisance
cardiaque, syndrome métabolique) la somnolence diurne excessive est peu marquée
avec un Epworth moyen < 8/24(69). La somnolence n’est donc pas
suffisamment discriminative du SAOS dans ces populations. Le
questionnaire d’Epworth n’est donc pas un questionnaire de dépistage du SAOS.
Notre proposition est donc de ne pas utiliser ces questionnaires dans la
population de patients avec un diabète. La présence d’au moins 3 des symptômes
listés dans l’encadré 2 conditionne le remboursement du traitement du SAOS chez
un patient ayant au moins 15 événements/h d’IAH. Nous proposons, pour le
dépistage, de recueillir en première intention et systématiquement ces
symptômes (encadré 2). Leur présence doit conduire à la réalisation d’un enregistrement nocturne
à visée diagnostique. Au-delà de ce raisonnement clinique « finaliste », nous
suggérons la réalisation d’un enregistrement nocturne indépendamment des
symptômes dans plusieurs situations spécifiques, dans lesquelles le traitement
par PPC est susceptible d’apporter un bénéfice au patient (encadré 3).

Références disponibles sur demande à : biblio@axis-santecom
Anne-Laure BOREL, pour le groupe « sommeil et diabète » de la Société francophone du diabète et col
07 JAN 2020
*Société francophone
du diabète (SFD), Société française de recherche et médecine du sommeil (SFRMS)
et Société de pneumologie de langue française (SPLF)
**R. TAMISIER, P. BÖHME, P. PRIOU, A. AVIGNON, F. ELGRABLY, P.-Y. BENHAMOU, H.
HANAIRE, J.-L. PÉPIN, L. KESSLER, P. VALENSI, P. DARMON, F. GAGNADOU

